2025年3月11日,Arvinas和輝瑞共同宣布了ARV-471的3期VERITAC-2臨床試驗結(jié)果,結(jié)果顯示其雖在ESR1突變中發(fā)揮了非常不錯的療效,但對于ESR1野生型患者卻敗下陣來。
2025年6月2日,ARV-471在2025年ASCO大會上首次公布了其臨床Ⅲ期的詳細(xì)報告,進(jìn)一步驗證了其在ESR1突變的有效性與安全性,顯著優(yōu)于氟維司群(標(biāo)準(zhǔn)療法)。
2025年6月6日,美國食品藥品監(jiān)督管理局(FDA)就收到了ARV-471的上市申請,用于治療既往接受過內(nèi)分泌治療的“ER陽性/HER2陰性、ESR1突變”的晚期或轉(zhuǎn)移性乳腺癌患者,標(biāo)志著PROTAC這一創(chuàng)新療法成功走出了臨床階段。
20年來,PROTAC這個備受關(guān)注的創(chuàng)新藥技術(shù),有過被追捧的日子,也有過被看低的時候,如今首款PROTAC的上市已然在即,ARV-471仍是ESR1突變?nèi)橄侔╊I(lǐng)域全面超越傳統(tǒng)療法的里程碑產(chǎn)品,有望在未來繼續(xù)重塑整個乳腺癌治療格局!
為什么
PROTAC能超越傳統(tǒng)療法?
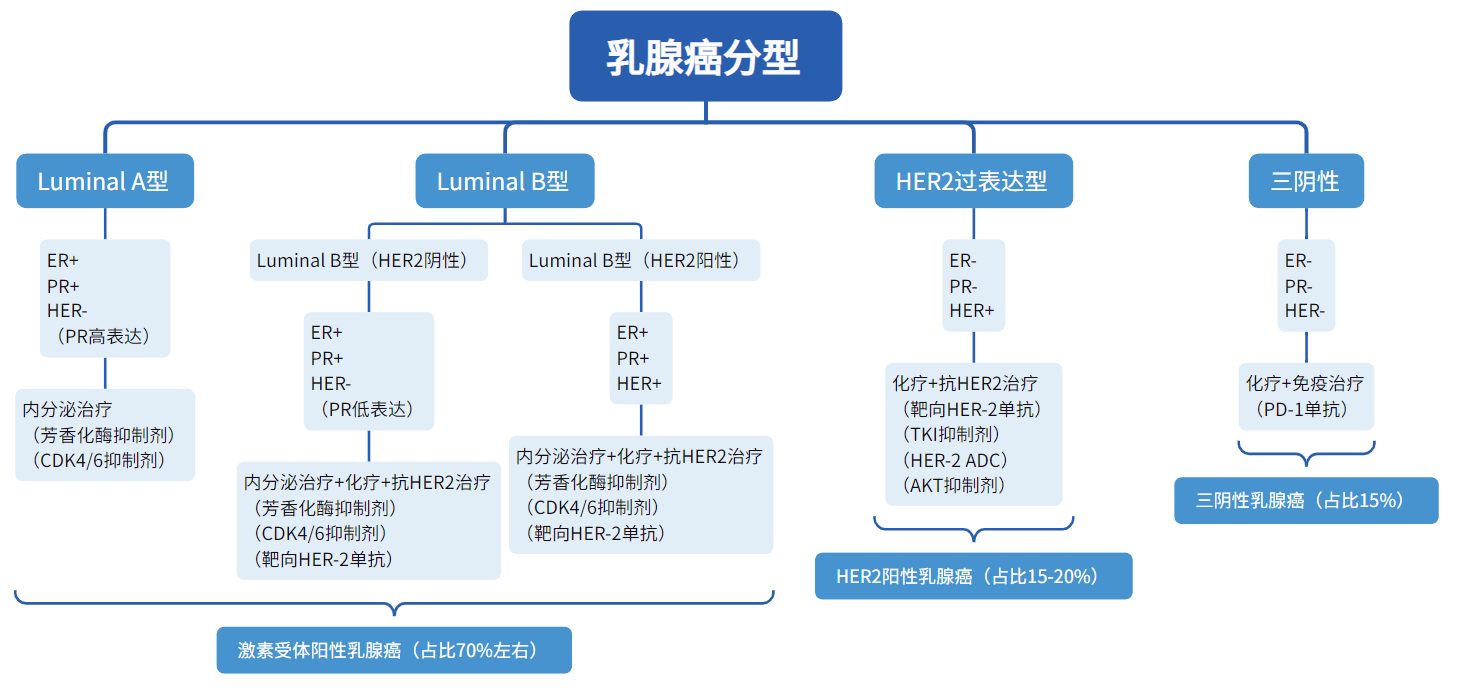
乳腺癌作為全球發(fā)病率最高的惡性腫瘤,根據(jù)其致病基因類型大致分為四種,即Luminal A型、Luminal B型、HER2過表達(dá)型與三陰型,其中雌激素受體陽性(ER+)乳腺癌占比最高(70%左右),理論上應(yīng)是乳腺癌中最大的細(xì)分市場。
數(shù)據(jù)來源:公開數(shù)據(jù)整理
同時,由于ER陽性乳腺癌對激素的嚴(yán)格依賴,臨床上HER-2單抗、PD-1單抗等熱門新藥的整體效果不佳,指南中建議的治療藥物主要為常規(guī)內(nèi)分泌藥物與CDK4/6抑制劑兩大類。
其中,能直接抑制ER信號通路的療法又可細(xì)分為三類,即芳香化酶抑制劑,選擇性ER調(diào)節(jié)劑和選擇性ER下調(diào)劑。
芳香化酶抑制劑:可阻斷雄激素轉(zhuǎn)化為雌激素,將抑制絕經(jīng)后女性體內(nèi)90%以上殘留的雌激素。代表藥物有來曲唑、依西美坦等。
選擇性ER調(diào)節(jié)劑通過與雌激素受體形成穩(wěn)定的復(fù)合物,從而使腫瘤細(xì)胞的生長受到抑制。代表藥物有他莫昔芬(TAM)、托瑞米芬。
選擇性ER下調(diào)劑(SERDS)則是通過下調(diào)ER水平和活性,全面抑制ER信號通路,代表藥物為氟維司群。
更關(guān)鍵的是,這幾類藥物對于初治型患者的療效相對顯著,Luminal A型5年生存率接近95.0%、Luminal B型5年生存率接近了77.5%,因此對于該類患者而言,其臨床需求重點已不再局限于“無藥可用”,反而是如何進(jìn)一步提高該疾病乳腺癌的生存周期,即將5年生存率指標(biāo)提升至10年生存率。而這其中首先需要解決的就是上述藥物后續(xù)的耐藥性問題。
而近年來,隨著生物技術(shù)的發(fā)展,多個新型ER靶點藥物涌現(xiàn),其中備受追捧的PROTAC技術(shù)在ER+乳腺癌領(lǐng)域展現(xiàn)出無限的治療潛力,就為解決ER+乳腺癌耐藥難題提供了一種全新的思路。
三大優(yōu)勢
奠定PROTAC的獨特性
原則上來講,PROTAC就像是“房產(chǎn)中介”,其一端與目標(biāo)蛋白結(jié)合,另一端與細(xì)胞內(nèi)的E3泛素連接酶結(jié)合,將一個個需要“出售房產(chǎn)”腫瘤細(xì)胞打上標(biāo)記,然后蛋白酶體就會將這些被標(biāo)記的蛋白分解掉(買下來)。
其與傳統(tǒng)內(nèi)分泌治療相比,在機(jī)制上實現(xiàn)了三大突破:
首先,與傳統(tǒng)小分子抑制劑基于“占據(jù)驅(qū)動”的作用機(jī)制不同,PROTAC遵循“事件驅(qū)動”機(jī)制,與靶蛋白的結(jié)合也并不局限于占據(jù)蛋白的“結(jié)合口袋”,理論上,只要與靶蛋白任意部位結(jié)合,便能實現(xiàn)整個靶蛋白的降解,而非單純抑制其功能。
其次,在常規(guī)小分子抑制劑治療過程中,當(dāng)靶蛋白發(fā)生突變時,可能導(dǎo)致小分子與靶蛋白的結(jié)合受阻,進(jìn)而產(chǎn)生對突變體的耐藥性,而PROTAC與靶蛋白的結(jié)合不受此類突變影響,因此其在應(yīng)對小分子耐藥性方面具備顯著優(yōu)勢。
最后,不同于傳統(tǒng)小分子抑制劑的劑量依賴性,PROTAC可以在引發(fā)蛋白降解后即從復(fù)合物中分離,并進(jìn)入下一個催化循環(huán),理論上可在較低濃度下實現(xiàn)大部分靶蛋白的降解,藥物作用效率高,有望延長藥物作用時間。在ARV-471一項Ib期聯(lián)合哌柏西利研究中,其ESR1突變亞組中位PFS達(dá)13.7個月,反應(yīng)持續(xù)時間14.6個月。
從這方面來看,PROTAC已不僅僅是一款創(chuàng)新藥種類,更像是一項可組合的技術(shù),將重新定義耐藥性乳腺癌治療。
自證之路
ARV-471邁入上市之路
作為臨床進(jìn)度最快的PROTAC產(chǎn)品,ARV-471背負(fù)的既有醫(yī)藥產(chǎn)業(yè)對PROTAC技術(shù)的期待,也有眾多ESR1突變耐藥乳腺癌的希望。
在其關(guān)鍵的VERITAC-2三期臨床試驗中,Vepdegestrant展現(xiàn)出令人振奮的療效數(shù)據(jù)。這項涉及全球25個國家、624名患者的開放標(biāo)簽研究,專門針對曾接受CDK4/6抑制劑和內(nèi)分泌治療后仍進(jìn)展的難治性患者。
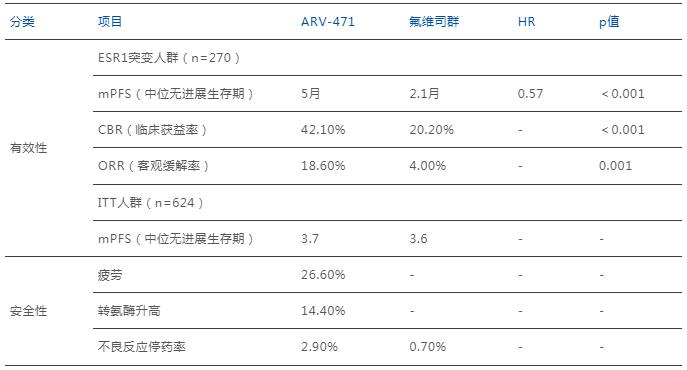
實驗中,270名攜帶ESR1突變的患者中,對比了ARV-471與氟維司群的臨床有效性與安全性,結(jié)果顯示ARV-471的多項數(shù)據(jù)均明顯優(yōu)于后者。
ARV-471 VS 氟維司群的III期臨床效據(jù)
數(shù)據(jù)來源:公開數(shù)據(jù)整理
其中,ARV-471的中位無進(jìn)展生存期(PFS)達(dá)5個月,顯著優(yōu)于氟維司群對照組的2.1個月,將疾病進(jìn)展或死亡風(fēng)險降低43%;實驗組客觀緩解率(ORR)達(dá)18.6%,是對照組的4倍多(4.0%);臨床獲益率(CBR)達(dá)42.1%,同樣顯著高于對照組的20.2%。
安全性方面,Vepdegestrant表現(xiàn)出良好的耐受性。最常見的不良反應(yīng)為疲勞(26.6%)、轉(zhuǎn)氨酶升高(14.4%)等,大多為1-2級。僅2.9%患者因不良反應(yīng)停藥,這一數(shù)據(jù)與對照組相當(dāng)(0.7%)。
綜合而言,ARV-471最大意義并非替代部分臨床療法,而是破解了ESR1突變耐藥困境,滿足其迫切的臨床需求。
紛至沓來
乳腺癌PROTAC繼續(xù)進(jìn)軍
在乳腺癌領(lǐng)域中,當(dāng)初ARV-471是第一個進(jìn)入臨床期研發(fā)階段的PROTAC藥物,如今去其多半又是第一個獲批上市的PROTAC藥物,它的問世,猶如一塊投入平靜湖面的巨石,在乳腺癌治療領(lǐng)域激起了層層漣漪,產(chǎn)生了深遠(yuǎn)且廣泛的影響。
更關(guān)鍵的是,在ARV-471仍有眾多PROTAC創(chuàng)新療法還在積極推進(jìn)中。
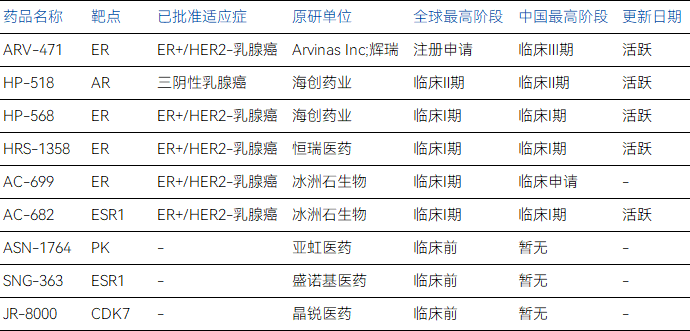
部分乳腺癌PROTAC管線與臨床階段
數(shù)據(jù)來源:藥智數(shù)據(jù)、藥智咨詢整理
其中,繼ARV-471之后,乳腺癌PROTAC領(lǐng)域幾乎被中國藥企所占領(lǐng),恒瑞醫(yī)藥、海創(chuàng)醫(yī)藥與冰洲石生物正是其中顯著代表。
恒瑞醫(yī)藥:HRS-1358
HRS-1358是恒瑞醫(yī)藥自研的一款ER靶點PROTAC新藥,其能夠強(qiáng)效且高選擇性地降解ER,抑制ER轉(zhuǎn)錄活性及下游信號,進(jìn)而抑制腫瘤細(xì)胞增殖,發(fā)揮抗腫瘤作用。其也是嚴(yán)格對標(biāo)ARV-471的一款PROTAC產(chǎn)品。
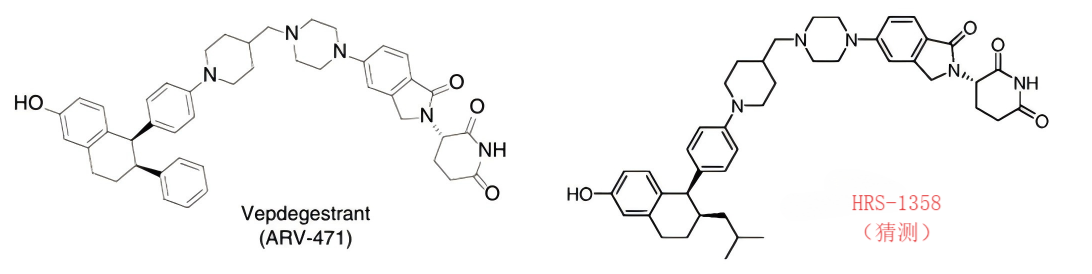
圖注:左為ARV-471結(jié)構(gòu)式;右為預(yù)估HRS-1358的結(jié)構(gòu)式
圖片來源:Innodrugs
2022年11月,該藥首次獲批開展臨床試驗。
2024年7月,HRS-1358獲批開啟了與新型高選擇性CDK4/6抑制劑羥乙磺酸達(dá)爾西利片的聯(lián)合臨床試驗。
2024年10月,HRS-1358獲批開啟了聯(lián)合HRS-2189(選擇性CDK4抑制劑)和HRS-6209用于惡性腫瘤的治療。
目前,該藥已處于臨床I/Ⅱ期階段,整體進(jìn)度略低于其另一款A(yù)R靶點PROTAC新藥HRS-5041,截至2024年,HRS-1358相關(guān)項目累計投入研發(fā)費用已超過7300萬元。
冰洲石生物:AC682/AC699
作為國內(nèi)少數(shù)專注PROTAC技術(shù)的創(chuàng)新企業(yè),成立于國內(nèi)創(chuàng)新藥開始萌芽的2015年,誕生之初就聚焦于“AI+醫(yī)藥研發(fā)”方向,旨在使用AI技術(shù)賦能的藥物研發(fā)環(huán)節(jié)包括靶點發(fā)現(xiàn)、苗頭化合物識別和驗證、先導(dǎo)化合物的識別、優(yōu)化和臨床選擇,是一家典型的醫(yī)藥研發(fā)型企業(yè)。
在PROTAC技術(shù)方向,冰洲石生物一共有4款PROTAC管線進(jìn)入了臨床,其分別是AC0699、AC0682,AC0176,AC0676,其中AC0699與AC0682為靶向ER,AC0176為靶向AR,AC0676則是靶向BTK。

圖片來源:冰洲石生物官網(wǎng)
目前,AC0699與AC0682作為ERα嵌合降解劑,正處于I期臨床試驗中。2024年6月,ASCO大會上AC699單藥治療晚期或轉(zhuǎn)移性乳腺癌患者的I期研究初步結(jié)果得以公布,其客觀緩解率(ORR)為21%,其中ESR1突變患者的ORR達(dá)到了50%。被投資者認(rèn)為具有成為領(lǐng)域內(nèi)BIC藥物的潛力。
而根據(jù)其過往與Evommune進(jìn)行人工智能藥物研發(fā)合作的經(jīng)歷來看,其根本上是一家兼具自主研發(fā)與技術(shù)服務(wù)商的多維角色,至少短期內(nèi)其管線后續(xù)發(fā)展(如臨床后期研究、商業(yè)化)都不太可能獨自承擔(dān),此次PROTAC的成藥性驗證,對其而言或許也不失為開拓License-out的大好機(jī)會。
海創(chuàng)醫(yī)藥:HP-518/HP-568
海創(chuàng)醫(yī)藥作為國內(nèi)擁有PROTAC靶向蛋白降解技術(shù)平臺的優(yōu)質(zhì)Biotech企業(yè),其自2016年起開始建設(shè)PROTAC技術(shù)平臺,在多個腫瘤靶點進(jìn)行PROTAC新藥開發(fā),目前一共擁有兩款臨床階段的PROTAC產(chǎn)品,分別是靶向“AR”的HP-518與靶向“ER”的HP-568。
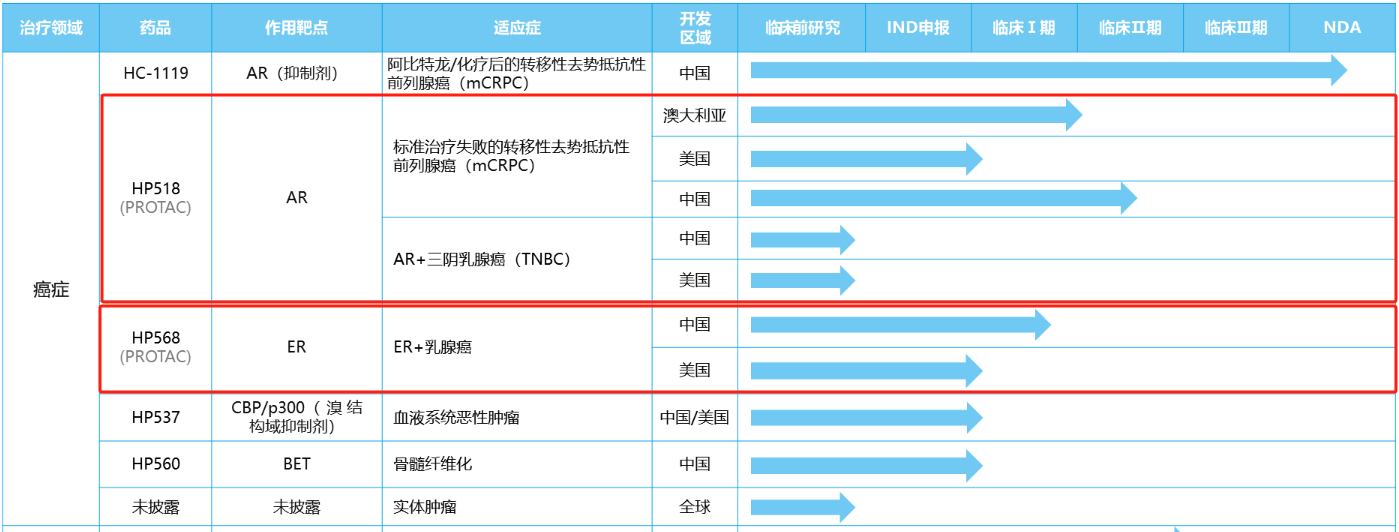
圖片來源:海創(chuàng)醫(yī)藥官網(wǎng)
HP518作為中國首款進(jìn)入臨床階段的口服AR PROTAC在研藥物,具有解決AR突變前列腺癌耐藥性的潛力。在早期動物實驗中,其對野生型AR及恩扎盧胺耐藥的變異AR都有很高的降解活性,開發(fā)的主要適應(yīng)癥方向為前列腺癌與乳腺癌。目前,該藥的I期臨床試驗在澳大利亞開展,用于AR陽性三陰乳腺癌并獲美國FDA授予快速通道認(rèn)定。
HP568作為海創(chuàng)醫(yī)藥新的一款靶向ER的PROTAC藥物,擬與HP518形成差異化競爭,用于治療雌激素受體陽性和人表皮生長因子受體2陰性的晚期乳腺癌(ER+/HER2-晚期乳腺癌)。早期臨床前研究結(jié)果顯示,HP568通過特異性催化ERα發(fā)生蛋白酶體依賴的快速降解發(fā)揮其抗增殖活性,HP568對ERα野生型(wild-type,WT)蛋白和臨床常見的ERα突變蛋白均具有極強(qiáng)的降解活性。目前,該藥已進(jìn)入臨床I期階段。
當(dāng)然,PROTAC技術(shù)的布局方向絕不局限于乳腺癌領(lǐng)域,在其他腫瘤、免疫和炎癥性疾病中,其也擁有不俗的實力,其整體進(jìn)度反而略優(yōu)于乳腺癌,比如:
百濟(jì)神州靶向BTK的BGB-16673,已于2025年2月啟動了治療BTK和BCL-2經(jīng)治CLL的3期研究,是目前全球PROTAC在研管線中僅次于ARV-471的存在。
賽諾菲靶向IRAK4的KT-474目前已處于2期臨床開發(fā)階段,用于治療化膿性汗腺炎(HS)和特應(yīng)性皮炎(AD)。
Nurix靶向BTK的NX-5948,目前也已處于1b/2期臨床開發(fā)階段,擬用于治療復(fù)發(fā)/難治性華氏巨球蛋白血癥。
總體來看,目前PROTAC領(lǐng)域中進(jìn)入臨床階段的在研管線靶點超過10個,AR與BTK是目前整體最快的兩個靶點,同時也是新藥布局最高的靶點領(lǐng)域之一,而目前受ARV-471上市申請的事件影響,其成藥性驗證成功無異于是一劑PROTAC領(lǐng)域的強(qiáng)心針,有望為后續(xù)諸多管線帶來更多的目光,尤其是資本。
展望
PROTAC能否繼續(xù)進(jìn)階
盡管短期來看PROTAC技術(shù)的前景似乎一片光明,尤其是如今首款PROTAC產(chǎn)品的成藥性驗證成功,但其實PROTAC作為一項新興技術(shù)療法,背后仍有諸多挑戰(zhàn)需要面臨,比如:
生物利用度難題:口服PROTAC分子需要克服細(xì)胞膜屏障,確保有效細(xì)胞內(nèi)遞送。
組織特異性局限:目前PROTAC依賴的E3連接酶(如CRBN和VHL)在全身廣泛表達(dá),可能帶來脫靶風(fēng)險。
劑量效應(yīng)復(fù)雜性:與傳統(tǒng)藥物不同,PROTAC可能呈現(xiàn)“鉤狀效應(yīng)”,與劑量非線性關(guān)系,這既是優(yōu)點也是缺點。
療效有限:當(dāng)前研究中,ESR1突變患者的中位PFS為5個月,但僅比氟維司群對照組的數(shù)據(jù)高2月,臨床替代意義不那么明顯,仍有巨大的提升空間。
對此,醫(yī)藥研究者正在積極探尋PROTAC的進(jìn)階療法,包括開發(fā)新型E3連接酶配體以提高組織特異性、采用抗體偶聯(lián)降解劑(DAC)技術(shù)實現(xiàn)精準(zhǔn)遞送、無連接子PROTAC、RIPTAC、PROTAB等等。
以抗體偶聯(lián)降解劑(DAC)為例,其是將靶向蛋白降解劑與單克隆抗體通過連接子偶聯(lián)起來的新分子模式。與傳統(tǒng)ADC產(chǎn)品有著相似的結(jié)構(gòu)與作用機(jī)制,唯一的不同就是有效載荷從細(xì)胞毒性藥物變成了PROTAC。
而DAC新分子之所以被稱為PROTAC的進(jìn)階療法,其主要由于其兼具了PROTAC的催化特性與ADC的組織特異性,原則上DAC能在較低劑量下實現(xiàn)有效地降解目標(biāo)蛋白,既克服了靶向降解劑靶向性不足,也克服了ADC的高毒藥物的毒性局限性,更關(guān)鍵的是其還擁有了耐藥性回避與更廣泛的適用性。
事實上,近年來已有不少企業(yè)開始布局這一創(chuàng)新技術(shù)療法,但整體進(jìn)展緩慢且失敗率較高,比如艾伯維的ABBV-787,而其發(fā)展緩慢的原因則主要受限于PROTAC領(lǐng)域本身的發(fā)展未得到臨床充分驗證。而目前,隨著首款PROTAC分子成功走出臨床,后續(xù)基礎(chǔ)技術(shù)領(lǐng)域的研究深入,DAC發(fā)展或許有望進(jìn)一步提速。
小結(jié)
總結(jié)而言,ARV-471的上市標(biāo)志著PROTAC技術(shù)從實驗室走向臨床的里程碑,為ER+乳腺癌患者,尤其是ESR1突變耐藥群體提供了突破性的治療選擇。
盡管其療效(中位PFS 5個月)的數(shù)據(jù)并未達(dá)到跨越性增長,但通過?催化降解ER蛋白?的機(jī)制革新,PROTAC已證明其解決耐藥性難題的獨特價值。
未來,隨著中國藥企(如恒瑞的HRS-1358、冰洲石的AC699)加速布局,以及?DAC技術(shù)?對組織特異性的優(yōu)化,PROTAC有望進(jìn)一步穩(wěn)固其“耐藥后線療法”的基石地位,并逐步向一線治療逐步前行,甚至是在全腫瘤領(lǐng)域中全面開花。
當(dāng)然,作為創(chuàng)新療法的一員,其遼闊未來的另一面也是其面臨的巨大挑戰(zhàn),比如生物利用度困難與組織特異性局限等問題,未來,希望在基礎(chǔ)研究水平上漲的助力之下,PROTAC能成為下一個十年乳腺癌“去耐藥化”的核心驅(qū)動力,最終實現(xiàn)從“延長生存”到“功能性治愈”的愿景。







