6月10日,CDE官網顯示,第一三共申報的注射用德曲妥珠單抗(T-DXd, DS-8201a)擬納入優先審評,擬定適應癥為:單藥適用于治療既往接受過一種治療方案的局部晚期或轉移性HER2陽性成人胃或胃食管結合部腺癌患者。這是該藥第3次申請進入優先審評通道,此前兩次分別于2023年11月和2024年2月獲批納入。

圖片來源:CDE官網
德曲妥珠單抗是第一三共與阿斯利康聯合開發的靶向HER2的DXd抗體偶聯藥物(ADC),2024年全球銷售額突破250億元,同比增長38.41%,已在美國、日本、歐盟、中國等多個國家和地區獲批上市。
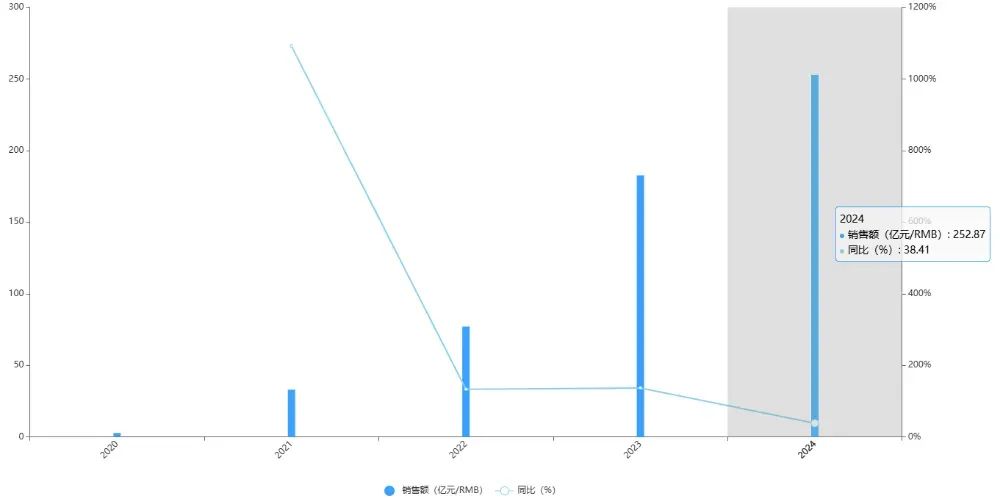
圖片來源:藥智數據企業版-全球暢銷藥品銷售數據
德曲妥珠單抗此前在國內已獲批4項適應癥,覆蓋HER2陽性/低表達晚期乳腺癌、HER2激活突變非小細胞肺癌,以及既往接受過兩種或兩種以上治療方案的HER2陽性晚期胃或胃食管結合部腺癌。
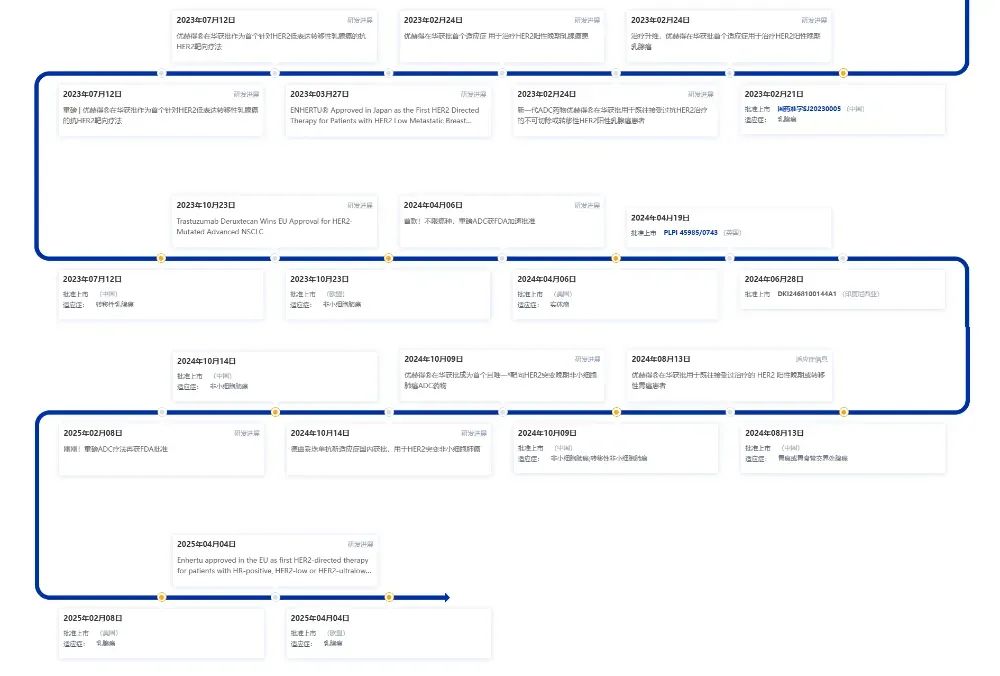
圖片來源:藥智數據企業版-全球藥物分析系統
據2020年WHO數據顯示,胃癌發病率排在全球第五,死亡率排名全球第三,而全球將近一半的新發和死亡病例都在中國。根據弗若斯特沙利文預測,2024-2030年全球胃癌藥物市場規模將從221億美元增長至364億美元,年復合增長率為8.7%。藥智數據顯示,近年來國內全終端市場胃癌藥物市場規模不斷增長,2024年已突破500億元。
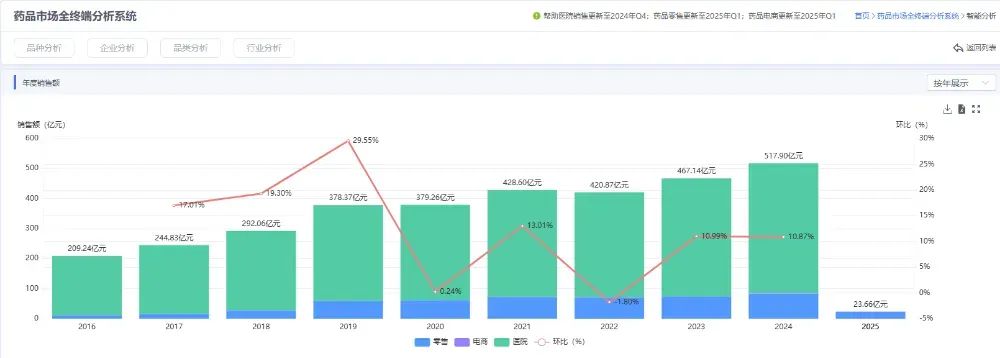
圖片來源:藥智數據企業版-藥品市場全終端分析系統
德曲妥珠單抗此次擬納入優先審評審批程序,若最終獲批,將為中國HER2陽性晚期胃癌患者帶來突破性改變。這場由優先審評開啟的“生命加速”,終將轉化為患者手中實實在在的生存希望。







