6月2日,再生元宣布與翰森制藥達(dá)成合作,獲得HS-20094中國以外的全球權(quán)益。翰森制藥獲得首付款8000萬美元,開發(fā)、注冊審批和商業(yè)化里程碑付款最高19.3億美元,以及基于產(chǎn)品銷售的特許權(quán)使用費(fèi)。
HS-20094為GLP-1/GIP雙受體激動劑,與禮來的暢銷藥替爾泊肽為相同靶點。再生元表示,從已觀察到的數(shù)據(jù),HS-20094的“潛在療效和安全性特征”與替爾泊肽相似。
目前,HS-20094正在中國進(jìn)行Ⅲ期臨床試驗,適應(yīng)癥為肥胖和超重。另外,針對2型糖尿病適應(yīng)癥的Ⅱ期臨床也在進(jìn)行中。
此前,再生元在減重賽道已多有嘗試,曾試圖開發(fā)長效GLP-1R激動劑ATDCs(antibody-tethered drug conjugates):將無拮抗活性的GLP-1R抗體與GLP-1RA偶聯(lián),提高GLP-1多肽類似物的穩(wěn)定性和半衰期。后來又將眼光投向“減脂增肌”領(lǐng)域,探索司美格魯肽+trevogrumab(抗GDF8/抗肌生長抑制素)聯(lián)合或不聯(lián)合garetosmab(抗激活素A)組合療法在減重和保護(hù)肌肉的雙重功能。
此次再生元制藥斥資逾20億美元引進(jìn)翰森制藥的GLP-1/GIP雙受體激動劑,此舉意在強(qiáng)化其GLP-1領(lǐng)域的藥物矩陣布局,也體現(xiàn)了再生元對臨床后期管線資產(chǎn)的戰(zhàn)略渴求,旨在彌補(bǔ)其現(xiàn)有研發(fā)管線中后期項目儲備不足的短板。
“抗體王者”的中年危機(jī)
作為Biotech先驅(qū),再生元制藥公司以其卓越的技術(shù)平臺立足,在抗體大分子藥物領(lǐng)域頗具盛名,先后締造了阿柏西普、度普利尤單抗兩款百億美元級重磅炸彈藥物。
依靠這兩款大單品的攻城略地,再生元市值曾在2024年達(dá)到1330億美元。
然而,進(jìn)入2025年,全球暢銷藥格局激變,GLP-1藥物領(lǐng)漲,而阿柏西普和度普利尤單抗遭遇瓶頸。
Eylea系列(阿柏西普及其高劑量版)面臨專利到期后的仿制藥競爭,以及羅氏VEGF-A/Ang2雙抗Vabysmo的迭代競爭,銷售額嚴(yán)重下滑。再生元財報顯示,Eylea系列2025Q1美國市場銷售額為10.43億美元,同比下降26%。全球銷售額(含拜耳合作部分)為19.01億美元,同比下降16%。
Dupixent(度普利尤單抗)雖然成功登頂自免“藥王”,然而在新適應(yīng)癥拓展上的不順利,導(dǎo)致其增長疲乏。該藥2025Q1全球銷售額34.8億歐元,同比增長20.3%。但相較于上一季度環(huán)比增長僅為0.69%。
除了阿柏西普和度普利尤單抗這兩大重磅產(chǎn)品,再生元還有一款PD-1抑制劑Libtayo,但其銷售額爬坡緩慢,2024年才剛剛突破十億美元,難以媲美前兩款重磅藥物。
而在研藥物方面,再生元廣泛布局抗腫瘤雙抗、新一代免疫藥物Itepekimab、AAV基因療法DB-OTO、肥胖組合療法等多個領(lǐng)域。
但是這些管線卻屢屢受挫。
IL-33單抗Itepekimab用于慢性阻塞性肺病(COPD)的Ⅲ期試驗AERIFY-1達(dá)到了主要終點,但Ⅲ期試驗AERIFY-2卻未達(dá)到相同的主要終點,兩項研究結(jié)果的不一致,需要進(jìn)一步的數(shù)據(jù)分析。
Odronextamab和Linvoseltamab兩款血液瘤雙抗雖然在歐盟獲批,但在美國上市遇挫,失去一大重要市場。
在核心產(chǎn)品競爭加劇與管線進(jìn)展不順利的雙重壓力下,再生元市值暴跌60%,目前僅約530億美元。
重金押注減重賽道
壓力之下,再生元把籌碼下注到了肥胖組合療法。
目前,trevogrumab是再生元肥胖領(lǐng)域的主要管線,這是一款靶向GDF8的單抗。再生元在近期公布了2期COURAGE研究的數(shù)據(jù):添加trevogrumab可使肌肉保留率提高51.3%,在此基礎(chǔ)上再添加garetosmab則可將保留率提升至80.9%。而且兩藥和三藥聯(lián)合方案的總體減重減輕分別為11.3%和13.2%,優(yōu)于單獨(dú)使用司美格魯肽的10.4%。不過,這一組合療法的安全性受到質(zhì)疑,有10.1%的患者出現(xiàn)嚴(yán)重不良反應(yīng),28.3%的患者完全停止治療。
無論如何,這一組合療法是一種有潛力的新型減肥方案。
基于此,再生元迅速與中國藥企翰森制藥達(dá)成合作,引進(jìn)一款臨床后期的GLP-1/GIP雙受體激動劑HS-20094。目的在于與其已有管線trevogrumab搭檔為組合藥物,以在“減脂增肌”領(lǐng)域形成優(yōu)勢,并探索在其他共病,如心血管疾病、糖尿病和肝臟疾病等領(lǐng)域的應(yīng)用。
HS-20094針對患有肥胖或伴有至少一種體重相關(guān)合并癥的超重成年患者的體重管理已于2024年進(jìn)入Ⅲ期臨床研究階段。
翰森制藥曾在2024 EASD年會上公布HS-20094的Ⅱ期臨床研究數(shù)據(jù)。研究總共有54例受試者,接受了至少一劑HS-20094、司美格魯肽或安慰劑。
在第23天,與安慰劑相比,HS-20094以劑量依賴性方式顯著降低了口服葡萄糖耐量試驗(OGTT)中的血糖AUC0-2h,且HS-20094 15mg組的降低幅度顯著大于司美格魯肽1.0mg組。第23天時,與安慰劑相比,HS-20094各劑量組OGTT 0分鐘和120分鐘的血糖水平均顯著下降。在第29天,與安慰劑相比,HS-20094各劑量組和司美魯肽組的HbA1c均顯著下降。HS-20094各劑量組的體重呈持續(xù)下降,下降幅度呈劑量依賴性,且均顯著優(yōu)于安慰劑組。HS-20094 15mg組體重較基線的下降幅度顯著優(yōu)于司美格魯肽組(3.29kgvs1.27kg,p=0.0024)。
安全性方面,報告的不良事件(AEs)中,絕大多數(shù)(98%)為輕度或中度,未報告與藥物相關(guān)的嚴(yán)重不良事件,無因不良事件導(dǎo)致的停藥,無死亡事件,也無重度低血糖事件。
有了HS-20094的加盟,再生元在減重領(lǐng)域有望再造下一個重磅炸彈療法。
結(jié)語
當(dāng)前,中國市場已躍升為全球制藥公司的重要戰(zhàn)略采購源,無論是亟待突破業(yè)績瓶頸的生物技術(shù)企業(yè),還是謀求賽道卡位的大型藥企,中國創(chuàng)新管線都是物美價廉的選擇。
在GLP-1領(lǐng)域,除了再生元,默沙東、諾和諾德、阿斯利康等公司也曾從中國藥企引進(jìn)候選藥物,印證了中國醫(yī)藥創(chuàng)新在成本控制、研發(fā)效率及差異化創(chuàng)新維度展現(xiàn)出顯著的全球競爭力。
表1近幾年國產(chǎn)GLP-1藥物交易匯總
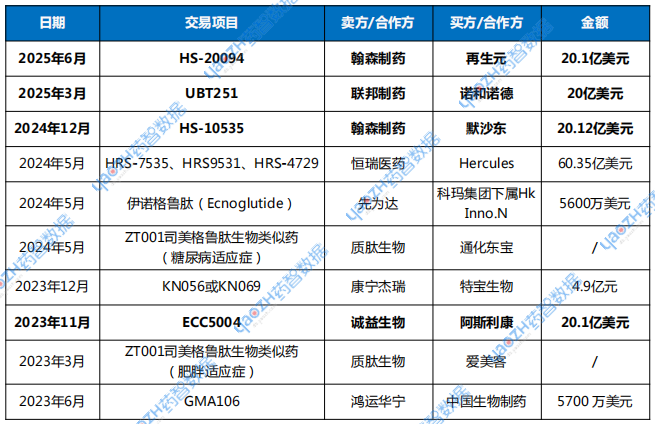
數(shù)據(jù)來源:藥智數(shù)據(jù)、公開資料整理







